1.什麼是化妝品?申請通過數量?
依據中國《化妝品衛生監督條例》將化妝品功能界定為“達到清潔、消除不良氣味、護膚、美容和修飾目的”。具體如下:
清潔作用:對皮膚、毛髮、指甲、口唇等部位的污垢、彩妝進行清潔,如潔面霜、沐浴液、洗髮香波、睫毛膏卸妝液等。
消除不良氣味:通過抑汗或掩蓋方法,達到減輕和消除體臭的作用,如抑汗劑、祛臭劑等。
護膚、護髮作用:保護皮膚,使皮膚滋潤、光滑和富有彈性,以抵禦寒風、烈日和紫外線等的損害,達到保持皮膚水分、延緩皮膚衰老的目的;保護毛髮,使毛髮柔順,達到防止毛髮枯斷的目的。如潤膚霜、防曬霜、潤髮油、護髮素等。
美容和修飾作用:對皮膚、毛髮、指甲、口唇等進行美化和修飾,達到美化容顏、賦予人體香氣的目的,如香粉、胭脂、唇膏、髮膠、染髮劑、燙髮劑和香水等。
判斷一個產品是否屬於中國法規定義的化妝品範疇,主要從以下三個方面考慮:
產品的使用方法 應是塗擦、噴灑或者其他類似的方法,如揉、抹、敷等,而以口服、注射等方式達到美容目的的產品不屬化妝品範疇。
產品施於人體的部位 應是人體表面任何部位,如皮膚、毛髮、指甲、口唇等,而牙齒、口腔黏膜等不在此範疇。
產品的功能和使用目的 應是以清潔、消除不良氣味、護膚、美容和修飾為目的,不具有預防和治療疾病的功能,這也是化妝品與藥品的本質區別。
目前,中國法規定義的化妝品不包括牙膏和其他與口腔黏膜接觸的產品。
2013年6月查詢之最新申請通過中國國產化妝品與進口化妝品的數據如下:
國產化妝品 18063支 進口化妝品 83726支
其數據可看出,1. 進口化妝品仍普遍受中國民眾信賴及歡迎,2.雖於許多品牌商於中國設工廠生產,成分配方與製程外流的風險考量下,海外品牌商仍願意申請批文來進口銷售。

2.化妝品分為哪些種類?
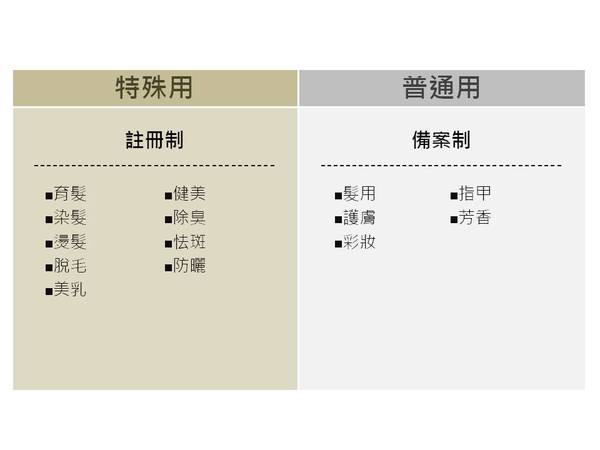
綜合來說,用於育發、染發、燙髮、脫毛、美乳、健美、除臭、祛斑、防曬的九類化妝品稱為特殊用途化妝品,除此之外的稱為普通用途化妝品(或非特殊用途化妝品),分為發用類、護膚類、彩妝類、指(趾)甲類和芳香類。
-
育發化妝品是指有助於毛髮生長、減少脫髮和斷發的化妝品。
-
染髮化妝品是指具有改變頭髮顏色作用的化妝品。
-
燙髮化妝品是指具有改變頭髮彎曲度,並維持相對穩定的化妝品。
-
脫毛化妝品是指具有減少、消除體毛作用的化妝品。
-
美乳化妝品是指有助於乳房健美的化妝品。
-
健美化妝品是指有助於使體形健美的化妝品。
-
除臭化妝品是指有助於消除腋臭的化妝品。
-
祛斑化妝品是指用於減輕皮膚表皮色素沉著的化妝品。
-
防曬化妝品是指具有吸收紫外線作用、減輕因日曬引起皮膚損傷功能的化妝品。
(資料來源: 北京食品藥品監督管理局CFDA http://www.sda.gov.cn/WS01/CL1195/)
3.CFDA中國食品藥品監督管理局審批(備案) 程序為何?
自2004年7月1日開始,中國國家衛生部簡化進口化妝品程式,特殊類產品仍沿襲原有的註冊制,而普通類產品則實行備案制。二者在程式上基本相同,不同的是前者在受理後需由評審委員會進行技術審評。
-
進口普通化妝品的申報程式:需經過樣品檢驗、整理申報材料、申請備案、材料審核、核發備案憑證等程式。
-
進口特殊化妝品的申報程式:需經過樣品檢驗、整理申報材料、申請註冊、材料審評、核發註冊批件等程式。
4.什麼樣的化妝品由CFDA(藥監局)審批?
所有進口化妝品必須由國家食品藥品監督管理局(CFDA)審批。需要特別說明的是:進口化妝品審批及管理機構從2008年9月1日起由衛生部變更到設立在北京的國家食品藥品監督管理局(CFDA)。
5.化妝品申報涉及的機構有哪些?
化妝品的申報,主要涉及到四種機構:檢測機構(疾控中心);受理辦公室(CFDA行政服務中心);評審委員會(中保辦);行政審批部門(國家局)
-
檢測機構:接受企業的委託,負責對產品進行技術檢驗,並出具檢驗報告。
-
受理辦公室:負責對企業的申報材料進行初步審核,材料符合要求則受理並負責安排參加評審會;對於擬批准的產品上報CFDA;發放證書等。
-
評審委員會:負責對申報的產品進行技術評審,提出評審意見,建議批准或不予批准等。
-
行政審批部門:對通過了評審委員會技術評審的產品進行進一步審核,如符合相關法規的規定,則予以批准,經批准的產品發給化妝品批准文號,也就是所謂的批文或第一證。
6.樣品送到哪做檢驗?
2008年7月31日衛生部認定中國疾控中心環境與健康相關產品安全所等14家單位為化妝品衛生行政許可檢驗機構。
獲認定的檢驗機構及其檢驗項目的範圍分別是:中國疾控中心環境與健康相關產品安全所、廣東省疾控中心、上海市疾控中心、北京市疾控中心、遼寧省疾控中心、江蘇省疾控中心、浙江省疾控中心、四川省疾控中心和湖北省疾控中心9家單位為化妝品衛生安全檢驗機構,承擔《化妝品衛生行政許可檢驗規定》規定的全部微生物、衛生化學和毒理學檢驗專案。
中國人民解放軍空軍總醫院、上海市皮膚病性病醫院、中山大學附屬第三醫院、四川大學華西醫院和中國醫科大學附屬第一醫院5家單位為化妝品人體安全性和功效檢驗機構,承擔《化妝品衛生行政許可檢驗規定》規定的人體安全性和防曬功效檢測專案。
2013年更新更多機構配合檢驗,由食品藥品監督管理局公布之檢驗機構名單如下:
|
編 號
|
2013年 中國化妝品 27個行政許可檢驗機構
|
|
01
|
中國疾病預防控制中心環境與健康相關產品安全所 |
|
02 |
北京市疾病預防控制中心 |
|
03 |
遼寧省疾病預防控制中心 |
|
04 |
上海市疾病預防控制中心 |
|
05 |
江蘇省疾病預防控制中心 |
|
06 |
浙江省疾病預防控制中心 |
|
07 |
廣東省疾病預防控制中心 |
|
08 |
四川省疾病預防控制中心 |
|
09 |
中國人民解放軍空軍總醫院 |
|
10 |
上海市皮膚病醫院 |
|
11 |
中山大學附屬第三醫院 |
|
12 |
四川大學華西醫院 |
|
13 |
中國醫科大學附屬第一醫院 |
|
14 |
北京市藥品檢驗所 |
|
15 |
上海市食品藥品檢驗所 |
|
16 |
中國醫學科學院皮膚病醫院 |
|
17 |
廣東省藥品檢驗所 |
|
18 |
浙江省食品藥品檢驗所 |
|
19 |
山東省食品藥品檢驗所 |
|
20 |
福建省藥品檢驗所 |
|
21 |
廣州市藥品檢驗所 |
|
22 |
深圳市藥品檢驗所 |
|
23 |
湖北省疾病預防控制中心 |
|
24 |
中國食品藥品檢定研究院 |
|
25 |
遼寧省食品藥品檢驗所 |
|
26 |
廣西壯族自治區食品藥品檢驗所 |
|
27 |
福建省廈門市藥品檢驗所 |
7.申請化妝品需經過哪些檢驗?
化妝品一般要進行微生物檢驗、衛生化學檢驗、毒理學安全性實驗、人體安全及功能試驗。檢驗時間一般在2-4個月,有些特殊功能化妝品因為要做人體試驗,時間稍長。
-
微生物學檢驗:包括菌落總數、糞大腸菌群、金黃色葡萄球菌、銅綠假單胞菌、黴菌和酵母菌等檢驗項目;
-
衛生化學檢驗:包括汞、鉛、砷等衛生化學指標的檢測,斑蟊、氮芥、巰基乙酸、性激素、甲醛等禁、限用物質含量的檢測,以及 pH 值等其他檢測;
-
毒理學試驗:普通化妝品需要做的試驗包括急性皮膚刺激性試驗、急性眼刺激性試驗、多次皮膚刺激性試驗;特殊用途化妝品除以上三項試驗,還包括皮膚變態反應試驗、皮膚光毒性試驗、回復突變試驗、體外哺乳動物細胞染色體畸變試驗;具體試驗需根據實際產品而定。
-
特殊用途化妝品人體安全性和功效性評價:包括人體斑貼試驗、人體試用試驗、SPF值測定、PA值測定、防水性能測定等。
8.申請進口化妝品批文一般需要多長時間?
化妝品申報的時間,與以下幾個因素有關:
-
檢驗時間:
進口普通類化妝品檢驗週期,一般在40—60天內完成。特殊用途化妝品(除育發、健美類、美乳類產品)的各項試驗的純檢測週期,一般在80天內完成。防曬類產品如果加做SPF值試驗及PA試驗,時間需要適當延長。育發類、健美類、美乳類產品需要做人體試用試驗安全性評價,整個週期約為150天。
-
資料準備:
資料準備的情況,會影響申報的週期。如果資料準備符合CFDA相關規定和要求,評委會沒有異議或只需稍加修改,則可加快申報週期,否則會延長申報的週期。
-
評審時間:
自2009年1月起,審評中心決定將化妝品審評會議的週期調整為每月一次。會議一般在當月的最後一周召開,如遇法定節假日等特殊情況將根據實際情況進行調整,審評產品範圍為當月末受理的產品。
-
評審政策:
評委會可能會對某些技術問題提出新的看法,需要補充試驗,或需要申報單位元進一步提供資料,則可能會延長申報週期。進口非特殊用途化妝品須要通過中保辦審評辦公室的評審,隨時遞交材料,每周都有評審,特殊化品評審會每月招開一次,每次評審會歷時約一周,一般在月末最後一周。
|
總之,進口普通類化妝品一般在4-4.5個月取得批文,進口特殊類化妝品一般在6~8個月左右取得批文。
9.進口化妝品註冊所需準備哪些資料?
2013年所有進口化妝品大致需要準備的文件,請參考如下: (隨時以北京食品藥品監督管理局CFDA公布為準)
(一)進口化妝品行政許可申請表;*
(二)產品中文名稱命名依據;*#
(三)產品配方;*#
(四)生產工藝簡述和簡圖;*#
(五)產品品質安全控制要求;*#
(六)產品原包裝(含產品標籤、產品說明書);擬專為中國市場設計包裝的,需同時提交產品設計包裝(含產品標籤、產品說明書);*
(七)經國家食品藥品監督管理局認定的許可檢驗機構出具的檢驗報告及相關資料;*
(八)產品中可能存在安全性風險物質的有關安全性評估資料;*#
(九)申請育發、健美、美乳類產品的,應提交功效成份及其使用依據的科學文獻資料;*#
(十)已經備案的行政許可在華申報責任單位授權書影本及行政許可在華申報責任單位營業執照影本並加蓋公章;*#
(十一)化妝品使用原料及原料來源符合瘋牛病疫區高風險物質禁限用要求的承諾書;*
(十二)產品在生產國(地區)或原產國(地區)生產(公會/協會)和自有銷售(衛生署)的證明文件;*#
(十三)可能有助於行政許可的其他資料。
(十四)樣品#
注:*表示我公司負責的資料,#表示需要貴公司提供,*#表示雙方共同來做,我公司會提供樣本或建議。
若申報產品以委託加工方式生產的,除按以上規定提交材料外,還須提交下面資料:
委託方與被委託方簽訂的委託加工協議書;
進口產品應提供被委託生產企業的品質管制體系(ISO)或良好生產規範(GMP)的證明檔,如果沒有以上兩類證明檔,可由國家化妝品行業協會或政府部門開具良好品質證明;
而證明文件包含以下三種:
1、產品在生產國(地區)或原產國(地區)允許生產銷售的證明文件(化妝品公會/協會);
2、代理申報的,應提供委託代理證明;
3、國外生產廠家給國內在華責任單位開具的“授權書”;
10.產品配方有哪些規定?
(一)應標明全部成份的名稱、使用目的、百分含量,並按含量遞減順序排列;各成份有效物含量均以百分之百計,特殊情況(如有效物含量非百分之百、含結晶水及存在多種分子結構等)應詳細標明;
(二)成份命名應使用INCI名,國產產品可使用規範的INCI中文譯名,無INCI名的可使用化學名,但不得使用商品名、俗名;
(三)著色劑應提供《化妝品衛生規範》規定的CI號;
(四)成份來源於植物、動物、微生物、礦物等原料的,應提供拉丁文學名;
(五)含有動物臟器提取物的,應提供原料的來源、品質規格和原料生產國允許使用的證明;
(六)分裝組配的產品(如染發、燙髮類產品等)應將各部分配方分別列出;
(七)含有複配限用物質的,應申報各物質的比例;
(八)《化妝品衛生規範》對限用物質原料有規格要求的,申報單位元還應提供由原料供應商出具的該原料的品質規格證明。
而檢驗中特殊情況要求:
1、配方中紫外線吸收劑含量超過0.5%的非防曬產品,除需常規檢測外,還應進行紫外線吸收劑量檢測、光毒試驗和變態反應試驗;
2、產品宣稱含有果酸,或配方成份中含有果酸總量≥3%,應進行果酸含量檢測;
3、防曬產品宣傳或標示SPF值的,應提供相應的檢驗方法和檢驗結果。
11.如何加快審查進度呢?
化妝品申報的週期,與以下幾個因素有關:評審週期、檢驗週期、資料準備情況、評審政策:
1、化妝品的評審會議,主要是特殊類產品,能否趕上當月的評審會。
2、化妝品的檢驗週期,專業代理申報公司一般與檢驗機構有良好的合作關係,安排檢驗的時間一般比較快。
3、資料準備的情況,會影響申報的週期。如果資料準備較好,評委會沒有異議或只需稍加修改,則可縮短申報週期,否則會延長申報的週期。
4、評委會可能會對某些技術問題提出新的看法,需要補充試驗,或需要申報單位元進一步提供資料,則可能會延長申報週期。
5、總之,如想縮短化妝品申報的週期,則需合理安排各個環節的時間,有專業人員檢查申報材料,但不排除會受到評審政策的影響。
12.CFDA頒發的《批文》的準備文號格式是什麼樣的?
進口特殊用途化妝品批准文號體例為:
國妝特進字J******** ;
進口非特殊用途化妝品備案號體例為:國妝備進字J******** ;
國產特殊用途化妝品批准文號體例為:國妝特字G******** 。
批准文號中“********”的前4位為年份,後4位為行政許可的先後順序。
13.何謂 "收貨人備案制"?與所有辦証有何相關?
以下為中國國家品質監督檢驗檢疫總局所發布的資訊,請參閱:
【發佈單位】 國家品質監督檢驗檢疫總局
【發佈文號】 2012年第55號公告
【發佈日期】 2012-04-05
【生效日期】 2012-10-01
【效 力】
【備 注】 為進一步加強進口食品安全監管,根據《中華人民共和國食品安全法》及其實施條例、《國務院關於加強食品等產品安全監督管理的特別規定》和《進出口食品安全管理辦法》等法律、行政法規、規章的規定,國家質檢總局制定了《進口食品進出口商備案管理規定》和《食品進口記錄和銷售記錄管理規定》,現予以批准發佈,自2012年10月1日起施行。
附件:1. 《進口食品進出口商備案管理規定》
2. 《食品進口記錄和銷售記錄管理規定》
二〇一二年四月五日
第一章 總 則
第一條 為掌握進口食品進出口商資訊及進口食品來源和流向,保障進口食品可追溯性,有效處理進口食品安全事件,保障進口食品安全,根據《中華人民共和國食品安全法》、《國務院關於加強食品等產品安全監督管理的特別規定》和《進出口食品安全管理辦法》等法律、行政法規、規章的規定,制定本規定。
第二條 本規定適用于向中國大陸境內(不包括香港、澳門)出口食品的境外出口商或者代理商,以及境內進口食品的收貨人(以下統稱進出口商)的備案管理。
本規定附表所列經營食品種類之外的產品,如食品添加劑、食品相關產品、部分糧食品種、部分油籽類、水果、食用活動物等依照有關規定執行。
第三條 國家質檢總局主管進口食品進出口商備案的監督管理工作,建立進口食品進出口商備案管理系統(以下簡稱備案管理系統),負責公佈和調整進口食品進出口商備案名單。
國家質檢總局設在各地的出入境檢驗檢疫機構(以下簡稱檢驗檢疫機構)負責進口食品收貨人備案申請的受理、備案資料資訊審核,以及在食品進口時對進出口商備案資訊的核查等工作。
第二章 出口商或者代理商備案
第四條 向中國出口食品的出口商或者代理商,應當向國家質檢總局申請備案,並對所提供備案資訊的真實性負責。
第五條 出口商或者代理商應當通過備案管理系統填寫並提交備案申請表(附件1),提供出口商或者代理商名稱、所在國家或者地區、位址、連絡人姓名、電話、經營食品種類、填表人姓名、電話等資訊,並承諾所提供資訊真實有效。出口商或者代理商應當保證在發生緊急情況時可以通過備案資訊與相關人員取得聯繫。
出口商或者代理商提交備案資訊後,獲得備案管理系統生成的備案編號和查詢編號,憑備案編號和查詢編號查詢備案進程或者修改備案資訊。
第六條 出口商或者代理商位址、電話等發生變化時,應當及時通過備案管理系統進行修改。備案管理系統保存出口商或者代理商的所提交的資訊以及資訊修改情況。出口商或者代理商名稱發生變化時,應當重新申請備案。
第七條 國家質檢總局對完整提供備案資訊的出口商或者代理商予以備案。備案管理系統生成備案出口商或者代理商名單,並在國家質檢總局網站公佈。公佈名單的資訊包括:備案出口商或者代理商名稱及所在國家或者地區。
第三章 進口食品收貨人備案
第八條 進口食品收貨人(以下簡稱收貨人),應當向其工商註冊登記地檢驗檢疫機構申請備案,並對所提供備案資訊的真實性負責。
第九條 收貨人應當于食品進口前向所在地檢驗檢疫機構申請備案。申請備案須提供以下材料:
(一)填制準確完備的收貨人備案申請表;
(二)工商營業執照、組織機構代碼證書、法定代表人身份證明、對外貿易經營者備案登記表等的影本並交驗正本;
(三)企業品質安全管理制度;
(四)與食品安全相關的組織機構設置、部門職能和崗位職責;
(五)擬經營的食品種類、存放地點;
(六)2年內曾從事食品進口、加工和銷售的,應當提供相關說明(食品品種、數量);
(七)自理報檢的,應當提供自理報檢單位備案登記證明書影本並交驗正本。
檢驗檢疫機構核實企業提供的資訊後,准予備案。
第十條 收貨人在提供上述紙質檔材料的同時,應當通過備案管理系統填寫並提交備案申請表(附件2),提供收貨人名稱、位址、連絡人姓名、電話、經營食品種類、填表人姓名、電話以及承諾書等資訊。收貨人應當保證在發生緊急情況時可以通過備案資訊與相關人員取得聯繫。
收貨人提交備案資訊後,獲得備案管理系統生成的申請號和查詢編號,憑申請號和查詢編號查詢備案進程或者修改備案資訊。
第十一條 收貨人名稱、位址、電話等發生變化時,應當及時通過備案管理系統提出修改申請,由檢驗檢疫機構審核同意後,予以修改。備案管理系統保存收貨人所提交的資訊以及資訊修改情況。
第十二條 備案申請資料齊全的,檢驗檢疫機構應當受理並在5個工作日內完成備案工作。
第十三條 檢驗檢疫機構對收貨人的備案資料及電子資訊核實後,發放備案編號。備案管理系統生成備案收貨人名單,並在國家質檢總局網站公佈。公佈名單的資訊包括:備案收貨人名稱、所在地直屬出入境檢驗檢疫局名稱等。
第四章 監督管理
第十四條 檢驗檢疫部門對已獲得備案的進口食品進出口商備案資訊實施監督抽查。
各地檢驗檢疫機構通過對進口食品所載資訊核查出口商或者代理商的備案資訊,通過查驗有關證明材料或者現場核查收貨人所提供的備案資訊。
對備案資訊不符合要求的,應當要求其更正、完善備案資訊。不按要求及時更正、完善資訊的,應當將有關資訊錄入進出口食品生產經營企業不良信譽記錄。
第十五條 進口食品的收貨人或者其代理人在對進口食品進行報檢時,應當在報檢單中注明進口食品進出口商名稱及備案編號。檢驗檢疫機構應當核對備案編號和進口食品進出口商名稱等資訊與備案資訊的一致性,對未備案或者與備案資訊不一致的,告知其完成備案或者更正相關資訊。
第十六條
(一)出口商或者代理商在申請備案時提供虛假備案資料和資訊的,不予備案;已備案的,取消備案編號。
出口商或者代理商向中國出口的食品存在疫情或者品質安全問題的,納入信譽記錄管理,並加強其進口食品檢驗檢疫;對於其他違規行為,按照相關法律法規規定處理。
(二)收貨人在申請備案時提供虛假備案資料和資訊的,不予備案;已備案的,取消備案編號。
收貨人轉讓、借用、篡改備案編號的,納入信譽記錄管理,並加強其進口食品檢驗檢疫。
第五章附 則
第十七條 本規定自2012年10月1日起施行。
資料來源:中國國家食品藥品監督管理局

